 Potensiometri adalah cabang dari ilmu kimia yang mempelajari ilmu pengukuran potensial dari suatu elektroda. Pengukuran potensial elektroda banyak digunakan untuk dalam ilmu kefarmasian terutama untuk pengukuran pH. Metode analisis potensiometri ini didasarkan pada pengukuran potensial sel elektrokimia.
Potensiometri adalah cabang dari ilmu kimia yang mempelajari ilmu pengukuran potensial dari suatu elektroda. Pengukuran potensial elektroda banyak digunakan untuk dalam ilmu kefarmasian terutama untuk pengukuran pH. Metode analisis potensiometri ini didasarkan pada pengukuran potensial sel elektrokimia.
Potensiometri hanya digunakan untuk menentukan titik equivalen pada proses titrasi
Suatu eksperimen dapat diukur dengan menggunakan dua metode yaitu, pertama (potensiometri langsung) yaitu pengukuran tunggal terhadap potensial dari suatu aktivitas ion yang diamati, hal ini terutama diterapkan dalam pengukuran pH larutan air. Kedua (titrasi langsung), ion dapat dititrasi dan potensialnya diukur sebagai fungsi volume titran. Potensial sel, diukur sehingga dapat digunakan untuk menentukan titik ekuivalen. Suatu petensial sel galvani bergantung pada aktifitas spesies ion tertentu dalam larutan sel, pengukuran potensial sel menjadi penting dalam banyak analisis kimia (Basset, 1994).
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995).
Titik akhir dalam titrasi potensiometri dapat dideteksi dengan menetapkan volume pada mana terjadi perubahan potensial yang relatif besar ketika ditambahkan titran. Dalam titrasi secara manual, potensial diukur setelah penambahan titran secara berurutan, dan hasil pengamatan digambarkan pada suatu kertas grafik terhadap volum titran untuk diperoleh suatu kurva titrasi. Dalam banyak hal, suatu potensiometer sederhana dapat digunakan, namun jika tersangkut elektroda gelas, maka akan digunakan pH meter khusus. Karena pH meter ini telah menjadi demikian biasa, maka pH meter ini dipergunakan untuk semua jenis titrasi, bahkan apabila penggunaannya tidak diwajibkan (Basset, 1994).
Reaksi-reaksi yang berperan dalam pengukuran titrasi potensiometri yaitu reaksi pembentukan kompleks reaksi netralisasi dan pengendapan dan reaksi redoks. Pada reaksi pembentukan kompleks dan pengendapan, endapan yang terbentuk akan membebaskan ion terhidrasi dari larutan. Umumnya digunakan elektroda Ag dan Hg, sehingga berbagai logam dapat dititrasi dengan EDTA. Reaksi netralisasi terjadi pada titrasi asam basa dapat diikuti dengan elektroda indikatornya elektroda gelas. Tetapan ionisasi harus kurang dari 10-8. Sedangkan reaksi redoks dengan elektroda Pt atau elektroda inert dapat digunakan pada titrasi redoks. Oksidator kuat (KMnO4, K2Cr2O7, Co(NO3)3) membentuk lapisan logam-oksida yang harus dibebaskan dengan reduksi secara katoda dalam larutan encer (Khopkar, 1990).
Persamaan Nernst memberikan hubungan antara potensial relatif suatu elektroda dan konsentrasi spesies ioniknya yang sesuai dalam larutan. Potensiometri merupakan aplikasi langsung dari persaman Nernst dengan cara pengukuran potensial dua elektroda tidak terpolarisasi pada kondisi arus nol. Dengan pengukuran pengukuran potensial reversibel suatu elektroda, maka perhitungan aktivitas atau konsentrasi suatu komponen dapat dilakukan (Rivai, 1995).
Potensial dalam titrasi potensiometri dapat diukur sesudah penambahan sejumlah kecil volume titran secara berturut-turut atau secara kontinu dengan perangkat automatik. Presisi dapat dipertinggi dengan sel konsentrasi. Elektroda indikator yang digunakan dalam titrasi potensiometri tentu saja akan bergantung pada macam reaksi yang sedang diselidiki. Jadi untuk suatu titrasi asam basa, elektroda indikator dapat berupa elektroda hidrogen atau sesuatu elektroda lain yang peka akan ion hidrogen, untuk titrasi pengendapan halida dengan perak nitrat, atau perak dengan klorida akan digunakan elektroda perak, dan untuk titrasi redoks (misalnya, besi(II)) dengan dikromat digunakan kawat platinum semata-mata sebagai elektroda redoks (Khopkar, 1990).
Alat-alat yang dibutuhkan dalam metode potensiometri adalah :
- Ph Meter
 Pada prinsipnya pengukuran suatu pH adalah didasarkan pada potensial elektro kimia yang terjadi antara larutan yang terdapat didalam elektroda gelas (membrane gelas) yang telah diketahui dengan larutan yang terdapat diluar elektroda gelas yang tidak diketahui. Hal ini dikarenakan lapisan tipis dari gelembung kaca akan berinteraksi dengan ion hidrogen yang ukurannya relatif kecil dan aktif, elektroda gelas tersebut akan mengukur potensial elektrokimia dari ion hidrogen atau diistilahkan dengan potential of hidrogen.
Pada prinsipnya pengukuran suatu pH adalah didasarkan pada potensial elektro kimia yang terjadi antara larutan yang terdapat didalam elektroda gelas (membrane gelas) yang telah diketahui dengan larutan yang terdapat diluar elektroda gelas yang tidak diketahui. Hal ini dikarenakan lapisan tipis dari gelembung kaca akan berinteraksi dengan ion hidrogen yang ukurannya relatif kecil dan aktif, elektroda gelas tersebut akan mengukur potensial elektrokimia dari ion hidrogen atau diistilahkan dengan potential of hidrogen.
- Elektroda
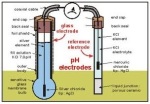 1) elektrode pembanding (refference electrode)
1) elektrode pembanding (refference electrode)
(2) elektroda indikator ( indicator electrode )
(3) alat pengukur potensial
1. Elektode Pembanding
Di dalam beberapa penggunaan analisis elektrokimia, diperlukan suatu elektrode pembanding (refference electrode) yang memiliki syarat harga potensial setengah sel yang diketahui, konstan, dan sama sekali tidak peka terhadap komposisi larutan yang sedang selidiki.. Pasangan elektrode pembanding adalah elektrode indikator (disebut juga working electrode) yang potensialnya bergantung pada konsentrasi zat yang sedang diselidiki
Syaratnya adalah:
- Mematuhi persamaan Nersnt bersifat reversible
- Memiliki potensial elektroda yang konstan oleh waktu
- Segera kembali keharga potensial semula apabila dialiri arus yang kecil
- Hanya memiliki efek hysterisis yang kecil jika diberi suatu siklus suhu
- Merupakan elektroda yang bersifat nonpolarisasi secara ideal
Elektroda pembanding ada beberapa macam, diantaranya :
a. Elektroda Kalomel (Saturated Calomel Electrode)
Elektroda Kalomelmerupakan elektrode yang terdiri dari lapisan Hg yang ditutupi dengan pasta Merkuri (Hg), Merkuri Klorida /Komel (Hg2Cl2) dan kalium klorida (KCl). Setengah sel elektrode kalomel dapat ditunjukan sebagai berikut:
KCl || Hg2Cl2 (sat’d), KCI (x M) | Hg
Dengan x menunjukkan konsentrasi KCl didalam larutan. Reaksi elektroda dapat dituliskan sebagai:
Hg 2CI2 (s) + 2 e¯ è 2 Hg (l) + 2 CI ¯
Potensial sel ini akan bergantung pada konsentrasi klorida x (pada kalomel yang tidak jenuh), dan harga konsentrasi ini harus dituliskan untuk menjelaskan elektroda.
Elektroda kalomel terbuat dari tabung gelas atau plastik dengan panjang 5 – 15 cm dan garis tengah 0,5 – 1 cm. Pasta Hg/HgCI terdapat di dalam tabung yang lebih dalam, dihubungkan dengan larutan KCI jenuh melalui lubang kecil. Kontak elektroda ini dengan larutan dari setengah sel lainnya melalui penyekat yang terbuat dari porselen atau asbes berpori.
b. Elektroda perak / perak klorida
Elektroda perak / perak klorida merupakan electrode yang terdiri dari suatu elektroda perak yang dicelupkan kedalam larutan KCI yang dijenuhkan dengan AgCI. Setengah sel elektroda perak dapat ditulis :
KCl | | AgCI (sat’d), KCI (xM) | Ag
Reaksi setengah selnya adalah
AgCI (s) + e- è Ag (s) + CI-
Biasanya elektroda ini terbuat dari suatu larutan jenuh atau 3,5 M KCI yang harga potensialnya dalah 0,199 V (jenuh) dan 0.205 V (3,5M) pada 250 C. Kelebihan elektroda ini dapat digunakan pada suhu yang lebih tinggi sedangkan elektroda kalomel tidak.
c. Elektrode Indikator (Indicator Elektrode)
Elektroda indikator (elektroda kerja) adalah suatu elektroda yang potensial elektrodanya bervariasi terhadap konsentrasi (aktivitas) analit yang diukur. Elektroda indikator harus memenuhi beberapa syarat antara lain harus memenuhi tingkat kesensitivan yang terhadap konsentrasi analit. Tanggapannya terhadap keaktifan teroksidasi dan tereduksi harus sedekat mungkin dengan yang diramalkan dengan persamaan Nernst. Sehingga adanya perbedaan yang kecil dari konsentrasi analit, akan memberikan perbedaan tegangan.
Elektroda indikator secara umum dikelompokkan menjadi 2 bagian yaitu :
a. Elektroda indikator logam
Elektroda logam adalah elektroda yang dibuat dengan menggunakan lempengan logam atau kawat yang dicelupkan ke dalam larutan elektrolit.
b. Elektroda redoks ( inert )
Logam mulia seperti platina, emas, dan paladium bertindak sebagai elektroda indikator pada reaksi redoks. Fungsi logam semata-mata untuk membangkitkan kecenderungan system tersebut dalam mengambil atau melepaskan electron; logam itu sendiri tidak ikut serta secara nyata dalam reaksi redoks, potensialnya merupakan fungsi Nersnt dari rasio aktivasi aFe2+/aFe3+. Tentu saja, inert merupakan ukuran relatif, dan platina tidak kebal dari serangan-seranga oksidator kuat, terutama dalam larutan dimana kompleksasi bias menstabilkan Pt(II) melalui pembentukan spesies.
Platina juga bisa menimbulkan masalah dengan reduktor-reduktor yang sangat kuat: reduksi H+ (atau H2O) kadang-kadang berlangsung sedemikian lambat sehingga analit-analit bias direduksi lebih dahulu dalam larutan air tanpa interfensi dari pelarutnya, tetapi karena H+ e = ½ Hkek2 dikatalis oleh platina, keuntungan kinetik ini mungkin hilang.
Contoh potensial elektroda platina di dalam larutan yanfg mengandung ion-ion Ce3+ dan Ce4+ adalah,
E = E0 – 0,059 log [Ce3+]/[Ce4+]
Dengan demikian elektroda platina dapat bertindak sebagai elektroda indikator di dalam titrasi cerimetri.
keuntungan motode potensiometri
- Bisa dilakukan untuk semua titrasi
- Kurva titrasi berhubungan antara potensial terhadap volume titran
- Digunakan bila :
- Tidak ada indikator yang sesuai
- Daerah titik equivalen sangat pendek
kekurangan metode potensiometri
- diperlukan pencampuran yang akurat dari volume standar maupun sampel yang akan diukur.
- diperlukan perhitungan yang lebih rumit.
- konsentrasi sampel harus diketahui.
 Sejak masa Hipocrates (460-370 SM) yang dikenal sebagai “Bapak Ilmu Kedokteran”, belum dikenal adanya profesi Farmasi. Saat itu seorang “Dokter” yang mendignosis penyakit, juga sekaligus merupakan seorang “Apoteker” yang menyiapkan obat. Semakin berkembangnya ilmu kesehatan masalah penyediaan obat semakin rumit, baik formula maupun cara pembuatannya, sehingga dibutuhkan adanya suatu keahlian tersendiri. Pada tahun 1240 M, Raja Jerman Frederick IImemerintahkan pemisahan secara resmi antara Farmasi dan Kedokteran dalam dekritnya yang terkenal “Two Silices”. Dari sejarah ini, satu hal yang perlu digarisbawahi adalah akar ilmu farmasi dan ilmu kedokteran adalah sama.
Sejak masa Hipocrates (460-370 SM) yang dikenal sebagai “Bapak Ilmu Kedokteran”, belum dikenal adanya profesi Farmasi. Saat itu seorang “Dokter” yang mendignosis penyakit, juga sekaligus merupakan seorang “Apoteker” yang menyiapkan obat. Semakin berkembangnya ilmu kesehatan masalah penyediaan obat semakin rumit, baik formula maupun cara pembuatannya, sehingga dibutuhkan adanya suatu keahlian tersendiri. Pada tahun 1240 M, Raja Jerman Frederick IImemerintahkan pemisahan secara resmi antara Farmasi dan Kedokteran dalam dekritnya yang terkenal “Two Silices”. Dari sejarah ini, satu hal yang perlu digarisbawahi adalah akar ilmu farmasi dan ilmu kedokteran adalah sama.



